癌细胞“自我背叛”:麻省理工团队开创mRNA驱动的全新抗癌策略
 找药助理
找药助理
关键词: #健康资讯
 找药助理
找药助理
关键词: #健康资讯
癌症作为全球第二大致死疾病,每年导致近千万人失去生命。根据世界卫生组织(WHO)数据,2022年全球新增癌症病例已超过2000万例,其中肺癌、乳腺癌与结直肠癌位居前三。尽管免疫疗法(特别是免疫检查点抑制剂)带来了肿瘤治疗的革命,但响应率低、全身副作用强的问题依旧困扰着临床应用。
最近,麻省理工学院及其合作团队在《美国国家科学院院刊》(PNAS)发表了一项突破性研究,通过让癌细胞“自产”免疫激活分子,成功实现了“让肿瘤自我毁灭”的全新治疗思路。
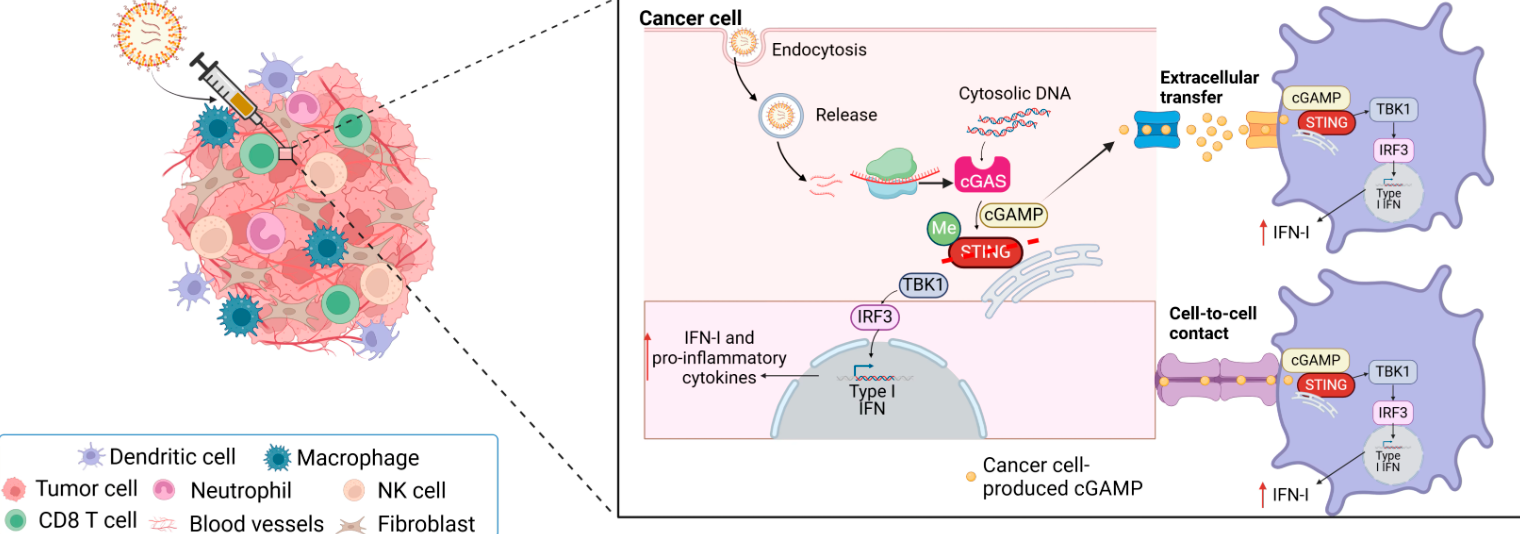
让癌细胞“自产”免疫武器:cGAS-STING通路的再激活
STING通路是机体天然免疫的核心,其被激活后能诱导干扰素及多种细胞因子产生,从而召集T细胞、NK细胞等免疫部队清除肿瘤。然而,传统STING激动剂疗法在临床中受制于高剂量需求与系统性炎症风险,限制了其应用。
这项研究选择了完全不同的策略——利用mRNA技术让癌细胞自行合成STING天然激活因子cGAMP。研究人员将编码cGAS(负责生成cGAMP的关键酶)的mRNA装载进脂质纳米颗粒中,并精准递送至肿瘤部位。进入细胞后,cGAS利用癌细胞中丰富的DNA碎片合成cGAMP,这些分子再向外扩散,激活邻近免疫细胞的STING通路,从内部启动抗肿瘤免疫反应。
双管齐下:mRNA疗法与免疫检查点抑制剂协同增效
在黑色素瘤小鼠模型实验中,单独使用cGAS mRNA或PD-1抑制剂均可显著延缓肿瘤生长,而联合治疗则让约30%的小鼠实现肿瘤完全消退。分析结果显示,该疗法能强力激活CD8+T细胞、NK细胞等“杀伤力量”,同时增强树突状细胞和巨噬细胞的抗原呈递功能,形成肿瘤免疫的协同“攻势网络”。
精准、低毒:突破传统免疫疗法瓶颈
与直接注射cGAMP不同,这种mRNA递送策略能在极低剂量下起效,并且其纳米载体能将mRNA锁定在肿瘤内部,防止分子扩散至全身,从而降低炎症及自身免疫风险。研究者形象地比喻道:“这就像在肿瘤内部建立一座‘制药工厂’,既节省运输又避免系统性副作用。”
创新意义:让癌细胞“反客为主”
这项工作实现了从“外部刺激”到“内部自激”的范式转变——研究者成功将癌细胞从免疫逃逸的“帮凶”转化为免疫激活的“主力”。通过重建cGAS功能,癌细胞被迫生产免疫激活分子,从而引发局部免疫反应,形成低毒、高效、精准的免疫防线。
此外,这一平台还具备灵活拓展性:只需替换mRNA编码序列,即可让癌细胞生成不同类型的免疫调控因子,为放疗、化疗及其他免疫疗法的联合提供技术基础。研究团队正计划开发静脉注射版本,以推动该策略进入临床试验阶段。
“以癌制癌”:未来免疫治疗的智慧之道
正如中国古语所言:“以彼之道,还施彼身。”这项研究正是利用癌细胞自身的资源,让其在体内生成摧毁自己的免疫武器。未来,随着mRNA技术与免疫治疗的进一步融合,我们或许不再需要“强攻”肿瘤,而是借助其内部矛盾“引爆”癌症,从内部瓦解病灶。
这种“让癌症自我崩塌”的创新理念,或将成为免疫治疗新时代的关键转折点。
2025-12-07

2025-12-07

2025-12-07

2025-12-07

2025-12-07