百利天恒BL-B01D1注射剂上市申请获CDE受理
 找药助理
找药助理
关键词: #健康资讯
 找药助理
找药助理
关键词: #健康资讯
11月21日,国家药品监督管理局药品审评中心(CDE)官网公示,百利天恒的创新药注射用BL-B01D1的上市申请已正式获得受理。
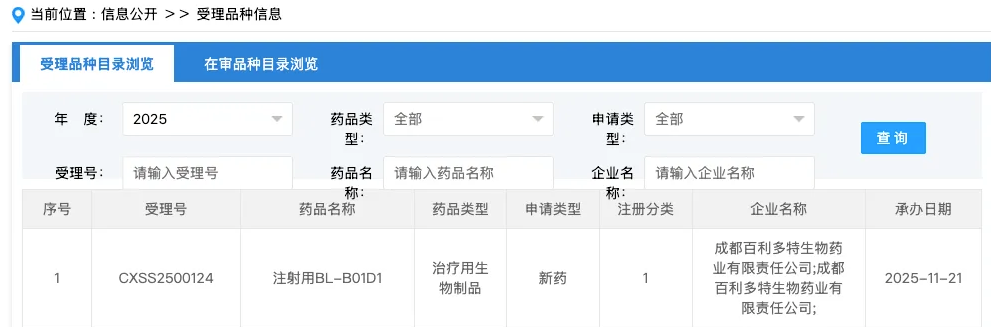
根据公司招股说明书及公开的临床进展信息推测,该药物主要用于鼻咽癌的治疗。值得注意的是,该适应症此前已被纳入药监局优先审评通道,显示出其在临床价值与创新性方面的重要地位。
全球首创双抗ADC药物,展现差异化竞争优势
BL-B01D1(iza-bren)是百利天恒自主研发的EGFR×HER3双特异性抗体偶联药物(ADC),为全球首创(First-in-class)产品。
该药物通过双靶点机制精准作用于肿瘤细胞,同时搭载细胞毒性载荷,实现高效靶向杀伤,兼顾疗效与安全性。此前,BL-B01D1已在食管鳞癌III期临床研究中取得突破性成果,成为全球首个在食管癌治疗中同时达到无进展生存期(PFS)和总生存期(OS)双阳性结果的ADC药物。
纳入优先审评,商业化进程加速
此次上市申请获受理,意味着BL-B01D1的商业化进程迈出关键一步。由于其所属适应症——鼻咽癌已被纳入优先审评名单,药品审评流程有望显著提速,为患者更早带来新的治疗选择。
业内人士指出,该产品一旦获批上市,将成为百利天恒继食管癌后又一关键布局,进一步巩固其在ADC领域的领先地位。
创新研发持续推进,开启多瘤种拓展
除鼻咽癌外,BL-B01D1在多种实体瘤领域均已布局临床研究,包括食管鳞癌、非小细胞肺癌等多个瘤种。公司正积极推进全球多中心临床试验,力求加速其全球注册与应用推广。
随着监管政策对创新药的持续支持,百利天恒有望在肿瘤ADC赛道上构建完整的产品矩阵,推动我国抗体偶联药物从“追赶”走向“引领”。

2025-12-05

2025-12-05

2025-12-05
2025-12-05

2025-12-05