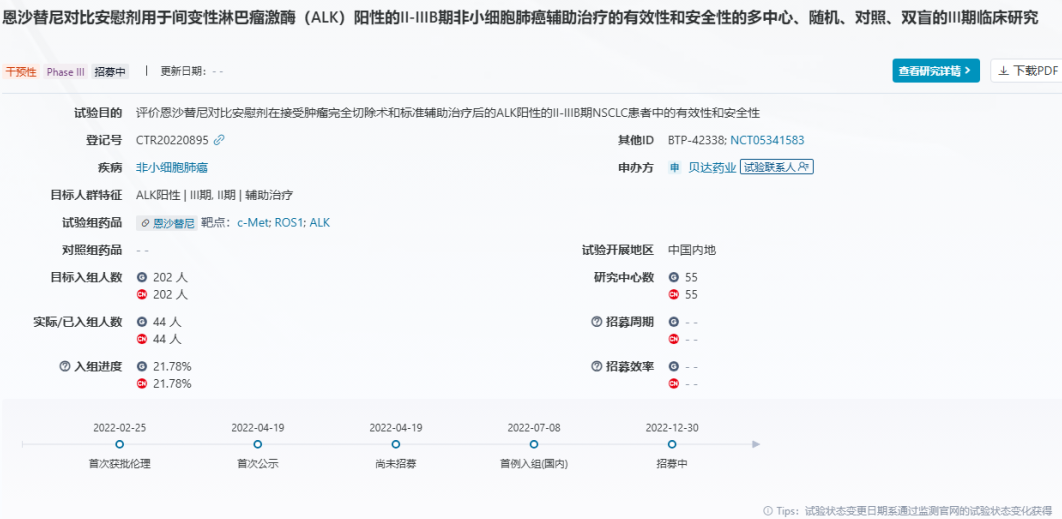
2025年8月22日,国家药品监督管理局(NMPA)官网公布,由第一三共与阿斯利康联合研发的靶向药物 德达博妥单抗(datopotamab
deruxtecan, Dato-DXd) 正式获批上市。该药物适用于治疗
既往接受过内分泌治疗且在晚期疾病阶段接受过至少一线化疗的不可切除或转移性HR阳性、HER2阴性乳腺癌(IHC 0、IHC 1+或IHC
2+/ISH-型)成人患者。 德达博妥单抗:创新靶向TROP2的ADC药物 德达博妥单抗是一款靶向 TROP2 的抗体偶联药物(ADC),采用了第一三共公司开发的 DXd ADC技术。 药物组成与机制: 靶向TROP2抗体:由人源化抗TROP2 IgG1单克隆抗体构成,与札幌医科大学联合开发,确保高靶向性。 可裂解四肽连接子:通过特定结构连接抗体与有效载荷,确保药物精准释放。 有效载荷:搭载拓扑异构酶I抑制剂(喜树碱类衍生物),在癌细胞内释放后,造成DNA损伤并有效抑制肿瘤增殖。 这一设计实现了高效靶向TROP2抗原的同时,最大程度降低对正常组织的影响,使得德达博妥单抗成为抗癌领域的重要创新。 关键性临床研究数据:疗效显著 德达博妥单抗的获批基于 TROPION-Breast 01研究(一项全球多中心III期临床试验)所获得的积极结果。研究重点评估了该药物相比标准化疗在
HR阳性、HER2阴性转移性乳腺癌患者中的疗效与安全性。 主要研究终点:无进展生存期(PFS) PFS显著改善: 经盲态独立中心影像评估(BICR),德达博妥单抗相比研究者选择化疗(ICC),显著降低了疾病进展或死亡风险 37%(HR=0.63;95%
CI:0.52-0.76;p<0.0001)。 疗效数据: 德达博妥单抗组:中位PFS为 6.9个月。 化疗组:中位PFS仅为 4.9个月。 在不同亚组中断续观察到一致的PFS获益,彰显药物的广谱作用。 客观缓解率(ORR) 德达博妥单抗治疗组的 ORR为36.4%,显著优于化疗组的 22.9%,展现了更高的肿瘤治疗有效性。 次要研究终点:总生存期(OS) 在截至数据截止日期的OS期中分析中,德达博妥单抗展示了比化疗更优的改善趋势(HR=0.84;95%
CI:0.62-1.14)。目前研究仍在继续进行,进一步随访将提供更完整的数据。 安全性与耐受性:显著优于化疗 德达博妥单抗表现出良好的安全性与耐受性特点: 治疗相关不良事件(TRAEs): 德达博妥单抗组:3级或以上TRAEs发生率为 21%,仅为化疗组的一半(化疗组为45%)。 常见副作用:未发现新的严重安全性问题,主要不良反应为轻中度。 药物的出色安全性使患者治疗体验得到显著改善,也进一步体现了DXd ADC技术的优势。 HR阳性、HER2阴性乳腺癌治疗市场与意义 乳腺癌是全球最常见的恶性肿瘤之一。在中国,根据统计,乳腺癌的发病率和死亡率持续居于高位,其中约
65-75%的乳腺癌患者为HR阳性、HER2阴性。这类患者的治疗选择相对有限,尤其对于转移性晚期乳腺癌,更需要更为精准、高效、安全的治疗方案。 市场机会:填补治疗空白 乳腺癌治疗的迫切需求:相比传统化疗方案,德达博妥单抗针对 内分泌治疗失败后患者,显著改善了PFS与ORR,为这一细分领域提供了突破性解决方案。 精准治疗与市场潜力:靶向TROP2的机制成为乳腺癌治疗的新方向,德达博妥单抗有望进一步扩展适应症,覆盖更多乳腺癌亚型。 展望:推动乳腺癌治疗技术革新 德达博妥单抗的上市,标志着靶向治疗与ADC技术在乳腺癌领域取得重要进展。不仅填补了HR阳性HER2阴性乳腺癌治疗领域的空白,也为全球患者提供了更优质的选择。 未来,随着研究的深入及适应症的扩展,德达博妥单抗有望在人类乳腺癌治疗中发挥更广泛的作用,成为精准治疗的典范,为患者带来更多治疗的希望和福音。