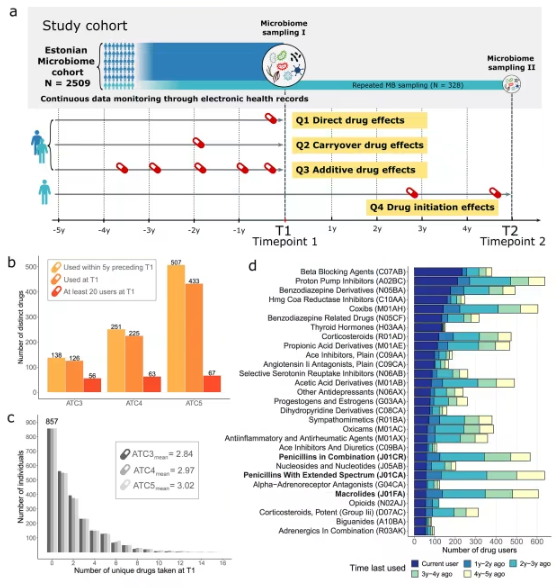
近年来,肠道菌群的研究已成为科学界的热门领域,与肠道菌群失调相关的慢性疾病,例如肥胖、糖尿病和炎症性肠病等,给全球约10%的人口带来严重健康负担。此外,抗生素使用导致的耐药性问题也引发了公共卫生挑战。而药物对肠道菌群长期效应的研究尚未深入,这种潜在隐患可能对疾病诊断和治疗产生深远影响。近日,《mSystems》杂志发表了一项重要研究,系统探讨了药物使用对肠道菌群的长期影响,为相关领域的探索提供了新方向。 爱沙尼亚队列:药物使用与菌群分析结合 研究团队利用爱沙尼亚微生物组队列(EstMB)中的2509名参与者(年龄23-89岁)的数据,通过电子健康记录(EHR)获取了过去5年的药物使用数据,同时结合肠道细菌的宏基因组测序数据进行分析。此外,328名参与者在中位随访时间4.4年后提供了第二份粪便样本,以验证长期药物效应。 实验设计 数据收集:记录参与者过去药物使用情况并采集粪便样本; 菌群测序:使用Illumina NovaSeq6000平台进行宏基因组测序; 统计分析:通过α/β菌群多样性评估及药物与菌群关联分析了解药物效应。 研究过程中总共分析了186种药物对14213个微生物操作分类单元(mOTUs)的影响。 主要发现:药物对肠道菌群的长期影响显著 研究结果显示,药物对肠道菌群既有短期效应,也存在显著的长期影响。以下为关键发现: 与肠道菌群显著相关的药物:186种药物中有167种(89.8%)显著影响肠道菌群的多样性或细菌丰度,其中包括β受体阻滞剂、大环内酯类抗生素及双胍类药物。 长期效应药物:78种药物(41.9%)显示出长期效应。即使停药后,其对肠道菌群的影响仍持续数年。例如: 大环内酯类抗生素:使用后超过3年仍显著影响细菌组成; 苯二氮䓬类药物:使用量多时效应累加,对菌群长期构成影响。 累积效应:药物使用量越大,对肠道菌群的扰动越强,例如双胍类药物显示显著累积效应。 验证长期效应:对328名参与者的第二份样本分析进一步确认了药物启动或停用对肠道菌群的持久影响。 药物与宿主健康的间接影响 研究不仅揭示了药物对肠道菌群的深远影响,还提示长期药物使用历史会通过菌群变化间接影响宿主健康。这种效应可能改变人体代谢、免疫反应甚至药物耐受性,需在疾病诊断和个性化治疗中考虑其重要性。 对疾病诊断与个性化医疗的启示 疾病与菌群关联研究应考虑药物历史 疾病与肠道菌群相关联的研究在设计时需加入既往药物使用数据,以避免“干扰变量”影响结论。 药物与肠道菌群双向影响 药物使用不仅改变菌群生态,菌群状态也可能影响药物效果及耐受性,为精准医疗提供新思路。 优化药物治疗方案 未来可通过调节肠道菌群改善药物治疗效果,例如结合益生菌或其他菌群调控策略。 未来研究方向 研究团队计划进一步探讨多种药物对不同人群中的具体影响,及如何通过菌群调节优化药物治疗。与此同时,将深入探索菌群对宿主代谢及慢性炎症疾病的长期贡献,为个性化医疗技术提供更多实践依据。 结论 这项研究首次系统评估了多种药物对肠道菌群的长期影响,揭示了一些关键药物的深远效应,强调在肠道菌群与健康研究中关注药物使用历史的重要性。药物对菌群的累积影响及其长期效应为个性化医疗、药物优化治疗开辟了新视角,同时也为公共卫生领域应对耐药性及菌群失调提供了借鉴。未来,我们有望通过结合菌群调控与精准用药,为人类健康管理提供更全面的解决方案。